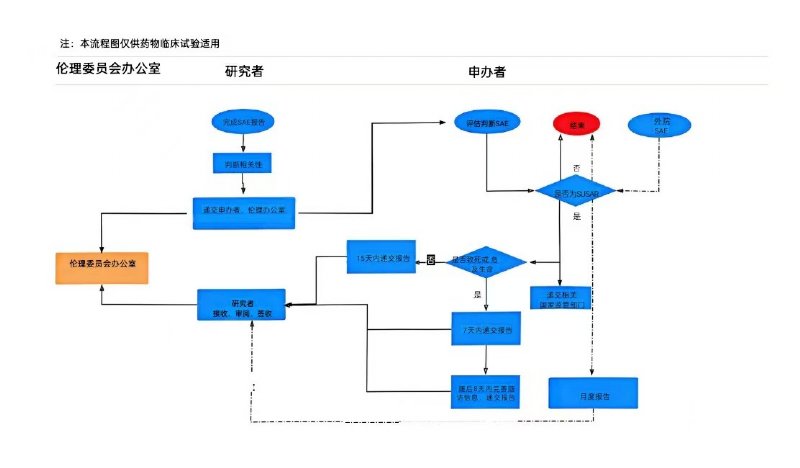
為落實《藥物臨床試驗質(zhì)量管理規(guī)范》(2020年7月1日施行)等要求,,切實做好我院臨床試驗安全性事件報告及管理工作,,及時發(fā)現(xiàn)并處理可能具有潛在風(fēng)險的研究項目,更好地保護受試者安全和權(quán)益,,特要求如下,,請各研究者和申辦者能夠積極配合并予以遵守:
1. 嚴(yán)重不良事件(SAE)的報告
(1)本院SAE:應(yīng)在獲知后24h內(nèi)報告給倫理委員會,隨后及時補充隨訪,、總結(jié)報告,。
(2)外院SAE:由申辦者進行分析評估后,,快速報告可疑且非預(yù)期嚴(yán)重不良反應(yīng)即可,。
2. 可疑且非預(yù)期嚴(yán)重不良反應(yīng)(SUSAR)的報告
(1)本院SUSAR遞交時限:
對于致死或危及生命的非預(yù)期嚴(yán)重不良反應(yīng),申辦者應(yīng)在首次獲知后盡快報告,,但不得超過7天,,并在隨后的8天內(nèi)報告、完善隨訪信息(申辦者首次獲知當(dāng)天為第0天);
對于非致死或危及生命的非預(yù)期嚴(yán)重不良反應(yīng),,申辦者應(yīng)在首次獲知后盡快報告,,但不得超過15天。
(2)非本院SUSAR遞交時限:按月度報告給倫理委員會,,同時遞交臨床試驗部備案,。
(3)報告要求:一般要求申辦者遞交主要研究者簽字后,再遞交倫理審查,;如遇特殊情況,,可由申辦者直接遞交倫理審查,但需附上主要研究者已獲知的證明材料,。
(4)報告形式
本院SUSAR遞交形式:紙質(zhì)版材料遞交至倫理辦公室簽收,。
非本院SUSAR遞交形式:紙質(zhì)版材料需以月報的形式遞交至倫理辦公室簽收。如果申辦者有比月報更高頻率向倫理報告SUSAR的要求,,可以發(fā)送郵件至635791633@qq.com,,倫理秘書將郵件回復(fù)予以簽收,紙質(zhì)材料仍需以月報的形式遞交,。
(5)審查形式
可疑且非預(yù)期嚴(yán)重不良反應(yīng)的倫理審查一般為快速審查,,如涉及嚴(yán)重問題危及受試者安全,可召開緊急倫理會議審查,;對于本院發(fā)生SUSAR的相關(guān)后續(xù)處理,,作為臨床試驗部在項目質(zhì)控工作中的重點內(nèi)容,。
(6)材料要求:不接收英文材料,。